在蛋白质研究中,精准定量是实验成功的基础。以下常规蛋白定量方法主要有:
|
方法 |
原理 |
优势 |
局限性 |
适用场景 |
|
BCA法 |
铜离子螯合显色反应 |
兼容去污剂、灵敏度高 |
受还原剂/螯合剂干扰 |
含SDS/Triton的裂解液样品 |
|
Bradford法 |
考马斯亮蓝G-250与蛋白结合变色 |
快速(5分钟)、经济、兼容还原剂 |
受去污剂干扰、线性范围窄 |
无去污剂的纯蛋白溶液 |
|
紫外吸收法 |
280nm处芳香族氨基酸吸光 |
无需试剂、无损检测 |
灵敏度低、受核酸干扰 |
层析洗脱液快速检测 |
|
Lowry法 |
改良双缩脲-福林酚显色 |
灵敏度高 |
步骤繁琐、试剂毒性大 |
历史方法,现已少用 |
一、ELISA检测组织样本为什么要做BCA总蛋白定量?
在组织样本ELISA实验中,BCA总蛋白定量是数据标准化的"黄金标尺",其意义体现在三个层面:
1. 消除样本间差异
不同组织块大小、细胞密度、裂解效率会导致总蛋白浓度差异巨大。若直接比较ELISA测得的绝对OD值,如同"比较不同体重的运动员举重的绝对重量"——毫无意义。
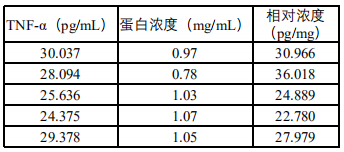
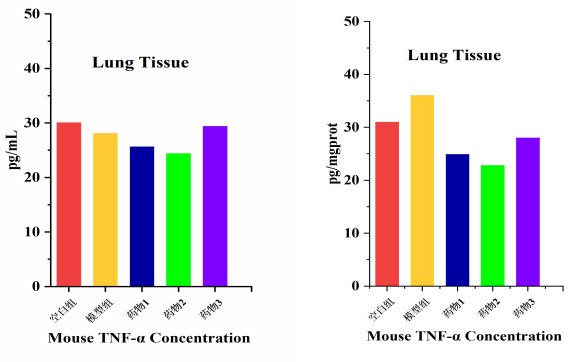
BCA总蛋白定量前后各组样本间TNF-α差异对比
2. 质量控制指标
-裂解效率评估:总蛋白浓度过低提示裂解不充分或样本降解
-异常样本识别:若某样本BCA值偏离均值>30%,需考虑重复实验或排除
3. 实验重复性验证
投稿时,审稿人必问:"ELISA数据是否经过总蛋白归一化?" 未进行BCA定量直接发表ELISA结果,会被视为**实验设计缺陷**,可能导致拒稿。
二、BCA法核心原理
基于双缩脲原理,碱性条件下蛋白质将Cu2+还原成Cu+,BCA鳌合Cu+作为显色剂,产生蓝紫色络合物,此络合物可用540-590nm波长检测,并在562 nm处有最大的光吸收值 。反应物的颜色和蛋白质浓度在一定范围内具有线性关系,故可以根据吸光度值的大小来测定蛋白的含量。
三、实验操作流程
工作液配制: 试剂A和试剂B按照体积比50:1比例混合 ,配成BCA工作液 。如取50 ml试剂A与1ml试剂B混合,配成51 ml BCA工作液 。两者混合时会有沉淀形成 ,彻底混匀后沉淀消失。
标准溶液配制:标准品临用前取20μL 5mg/mL BSA蛋白标准溶液用PBS溶液稀释100μL ,使其终浓度为1.0mg/mL。浓度梯度设置:0、25、125、250、500、1000、1500、2000μg/mL。
a 加入适当体积待测样本,并用PBS补足到20μL
b 向酶标板中加入BCA工作液200μL/孔,混匀,37℃放置30min(也可以室温放置2小时,或60 ℃放置30分钟 )。
c 测定562nm处的吸光值,并记录读数;以不含BSA的样品的光吸收值作为空白对照。
注: 冷却至室温后10分钟内完成读数,防止温度漂移影响结果
d 以562nm吸光值为纵坐标,BSA含量为横坐标,绘制标准曲线,计算样品中的蛋白浓度。如果所得到的蛋白浓度不在标准曲线范围内,请稀释样品后重新测定。
注: 由于BCA法测定时颜色会随着时间的延长不断加深,并且显色反应的速度和温度有关,所以每次测定都需要做标准曲线。
四、注意事项
1.实验所用耗材需去离子水冲洗2次并烘干,残留洗涤剂会抑制显色反应;
2.标曲必须每次实验新配:不同批次试剂、孵育条件差异会导致曲线偏移;
3.脑组织等高脂样本需丙酮脱脂预处理;
4.建议样本采集后-80℃分装保存,避免反复冻融导致蛋白降解。
